Здравствуйте, наши дорогие читатели! Вы, наверное, уже читали статью Лед из нашей Энциклопедии, в которой мы постарались рассказать о главных очевидных свойствах обыкновенного льда (если нет, то советуем для начала ознакомиться с ней), а теперь давайте перейдем к нашей следующей заметке и узнаем лучше его структурные возможности.
Мы все с вами привыкли видеть лед, держать его в руках, помним ощущения от прикосновения к холодной поверхности, знакомы с поведением льда, наблюдаем за процессом таяния и любуемся его прозрачностью. Но бывает ли другой лед, отличающийся от того, который мы знаем? Да, конечно бывает. Но давая более полный ответ на этот вопрос, нам следует его уточнить, так как существует несколько категорий, по которым мы можем различать тот или иной вид льда.
Во-первых, лед на Земле имеет различную природу происхождения – материковый лед, подземный, морской, атмосферный и т.д. А если говорить о разновидностях льда вне нашей планеты, то они серьезно отличаются от привычного нам, вследствие экстремальных условий в которых они образуются (читайте об этом в нашем разделе Космический лед).
И здесь уже можно перейти ко второй категории. Под словом «лед» мы привыкли понимать твердое фазовое состояние воды. Но помимо нее замораживанию подвергаются и другие вещества. Таким образом, лед можно различать по химическому составу исходного вещества, например, углекислый, аммиачный, метановый лед и другие.
В-третьих, различают кристаллические решетки (модификации) водяного льда, образование которых обусловлено термодинамическим фактором. Вот о них-то мы и поговорим немного в этой заметке.
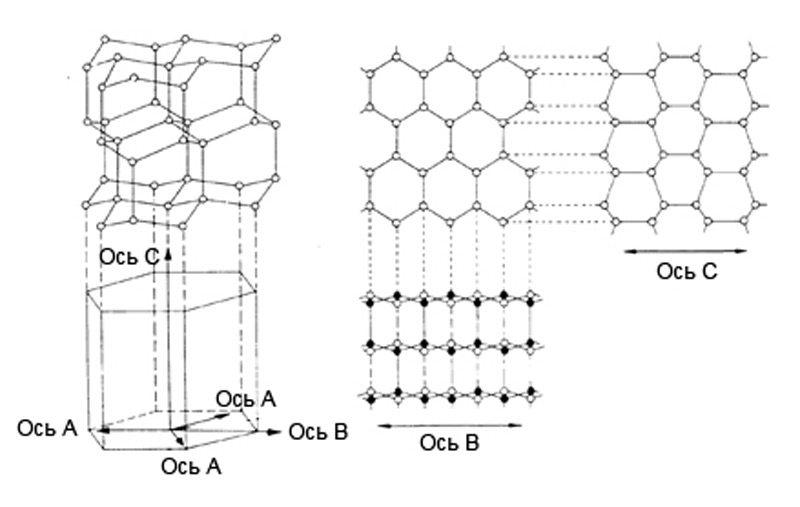
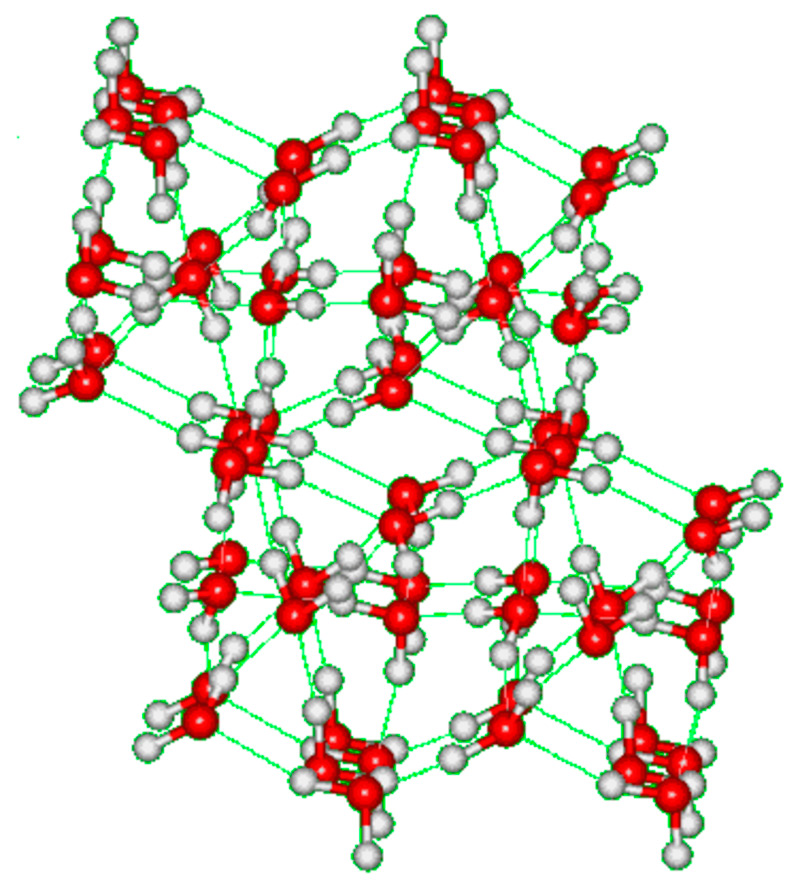
В статье Лед мы с вами остановились на том, как происходит перестройка структуры воды с изменением ее агрегатных состояний, и затронули кристаллическое строение обыкновенного льда. Благодаря внутреннему устройству самой молекулы воды и водородным связям, соединяющим все молекулы в упорядоченную систему, образуется гексагональная (шестиугольная) кристаллическая решетка льда. Ближайшие друг к другу молекулы (одна центральная и четыре угловых) расположены в форме трехгранной пирамиды, или тетраэдра, который лежит в основе гексагональной кристаллической модификации (илл.1).
Кстати, расстояние между мельчайшими частицами вещества измеряются в нанометрах (нм) или ангстремах (по имени шведского физика XIX века Андерса Йонаса Ангстрема; обозначается символом Å). 1 Å = 0,1 нм = 10−10 м.
Такое шестиугольное строение обыкновенного льда распространяется на весь его объем. Наглядно в этом можно убедиться невооруженным глазом: зимой во время снегопада поймайте снежинку на рукав одежды или на перчатку и приглядитесь к ее форме – она шестилучевая или шестиугольная. Это характерно для каждой снежинки, но при этом ни одна снежинка никогда не повторяет другую (подробнее об этом в нашей статье Снежинки – микроледяные скульптуры). И даже крупные кристаллы льда своей внешней формой отвечают внутреннему молекулярному строению (илл.2).
Мы уже говорили, что переход вещества, в частности воды, из одного состояния в другое осуществляется при наличии определенных условий. Привычный лед образуется при температуре от 0°C и ниже и при давлении в 1 атмосферу (нормальное значение). Следовательно, для появления иных модификаций льда требуется изменение этих значений, и в большинстве случаев наличие низких температур и высокого давления, при которых происходит изменение угла водородных связей и реконструкция всей кристаллической решетки.
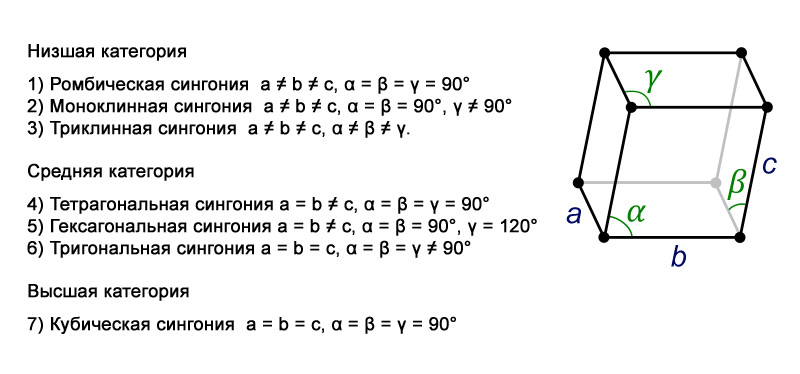
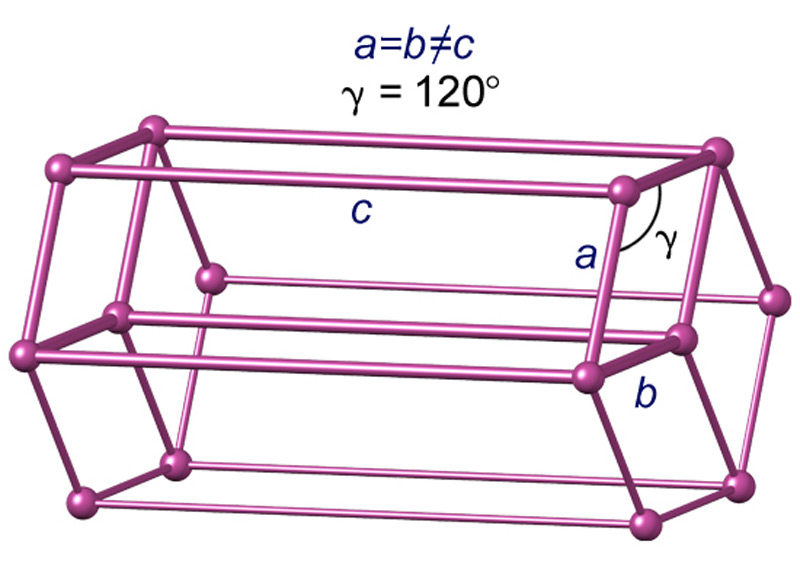
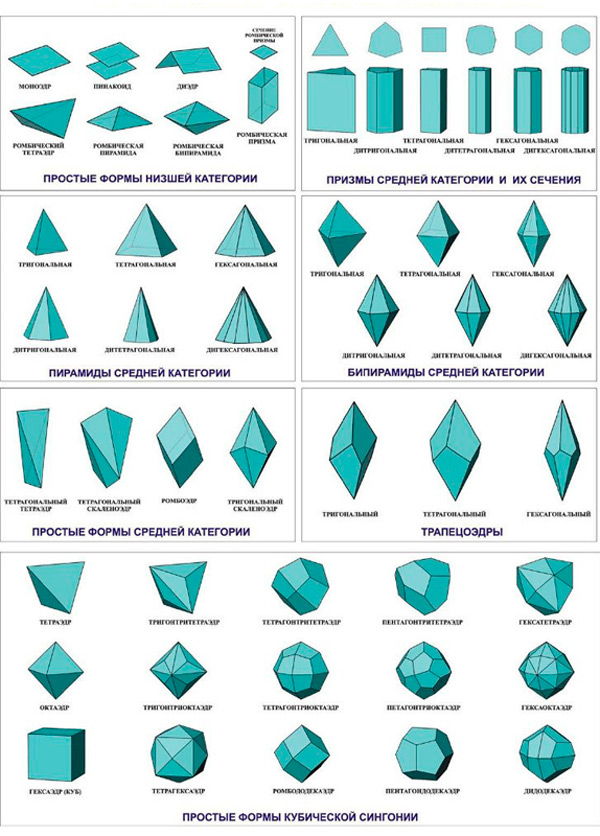
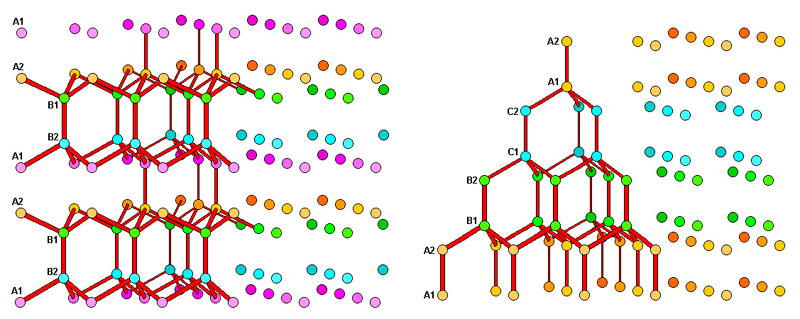
Каждая модификация льда относится к определенной сингонии – группе кристаллов, в которых элементарные ячейки обладают одной и той же симметрией и системой координат (оси XYZ). Всего же различают семь сингоний. Характеристики каждой из них представлены на иллюстрациях 3-4. А чуть ниже дано изображение основных форм кристаллов (илл.5)
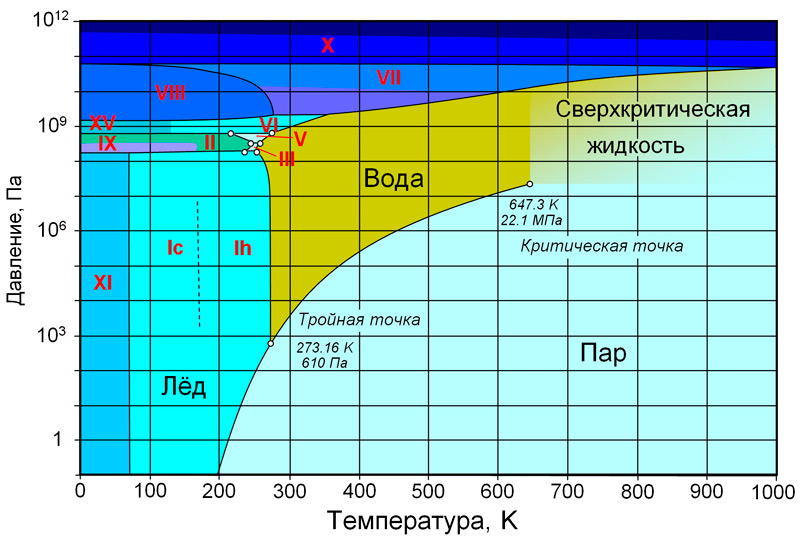
Все модификации льда, отличающиеся от обыкновенного, были получены в лабораторных условиях. О первых полиморфных структурах льда стало известно в начале XX века стараниями ученых Густава Таммана (Gustav Heinrich Tammann) и Перси Бриджмена (Percy Williams Bridgman). Диаграмма модификаций, составленная Бриджменом, периодически дополнялась. Новые модификации выявляли из полученных ранее. Последние изменения в диаграмму были внесены уже в наше время. На данный момент получено шестнадцать кристаллических типов льда. Каждый тип имеет свое наименование и обозначается римской цифрой.
Мы не будем вникать глубоко в физические характеристики каждого молекулярного типа водяного льда, чтобы не утомлять вас, уважаемые читатели, научными подробностями, отметим только основные параметры.
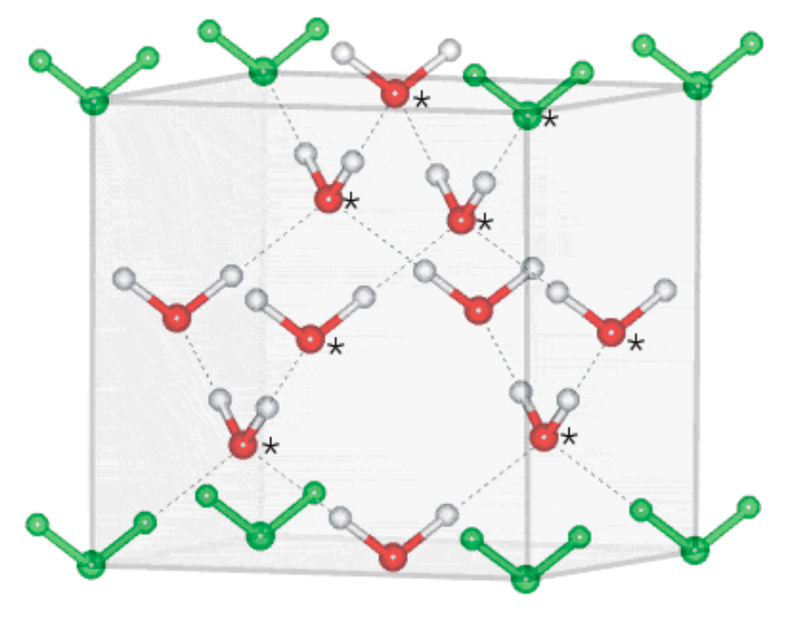
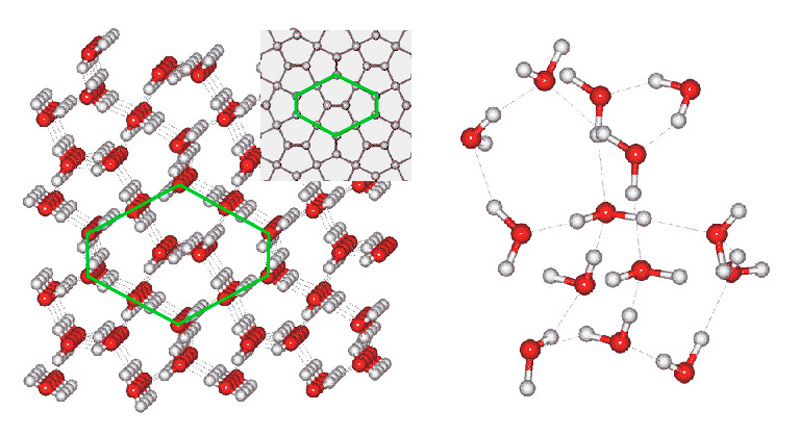
Обыкновенный лед носит наименование лед Ih (приставка «h» означает гексагональную сингонию). На иллюстрации 7 представлена его кристаллическая структура, состоящая из шестиугольных связок (гексамеров), которые отличаются по форме – одна в виде шезлонга (англ. chair-form), другая в виде ладьи (boat-form). Эти гексамеры формируют трехмерную секцию – два «шезлонга» находятся по горизонтали вверху и внизу, а три «ладьи» занимают вертикальное положение.
Илл. 7. Структура обычного (гексагонального) льда. Трехмерная секция из гексамеров («шезлонг» выделен сиреневым цветом, «ладья» – зеленым).
На пространственной схеме показан порядок в расположении водородных связей льда Ih, но в действительности связи выстраиваются случайным образом. Впрочем, ученые не исключают, что водородные связи на поверхности гексагонального льда более упорядочены, чем внутри структуры.
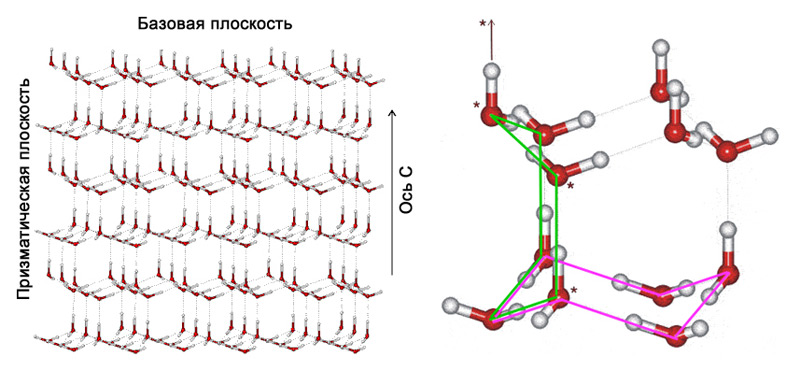
Элементарная ячейка гексагонального льда (т.е. минимальный объем кристалла, повторное воспроизведение которого в трех измерениях, образует всю кристаллическую решетку в целом) включает в себя 4 молекулы воды. Размеры ячейки составляют 4,51 Å по сторонам a,b и 7.35 Å по стороне с (сторона, или ось с на схемах имеет вертикальное направление). Углы между сторонами, как видно из иллюстрации 4: α=β = 90°, γ = 120°. Расстояние между соседними молекулами равно 2.76 Å.
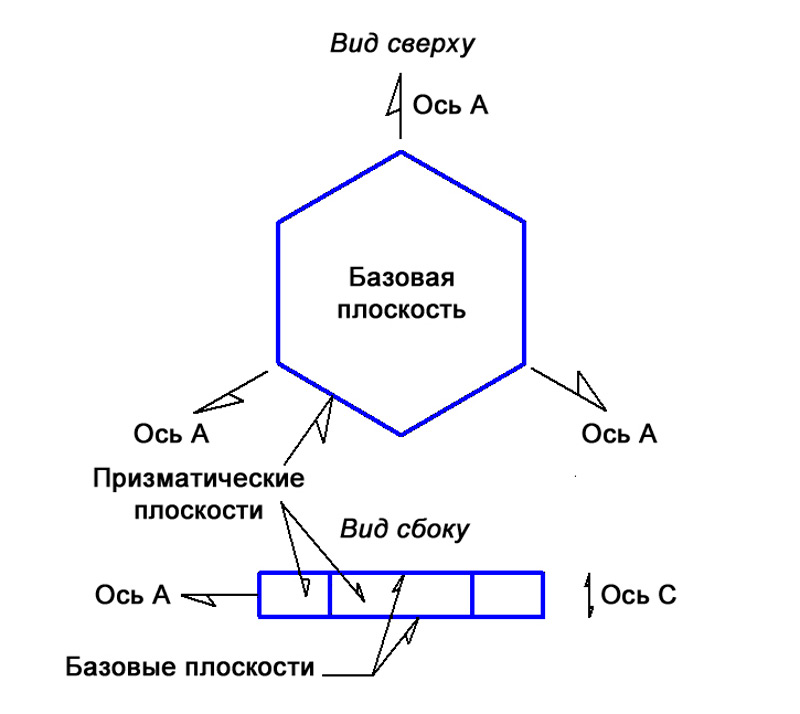
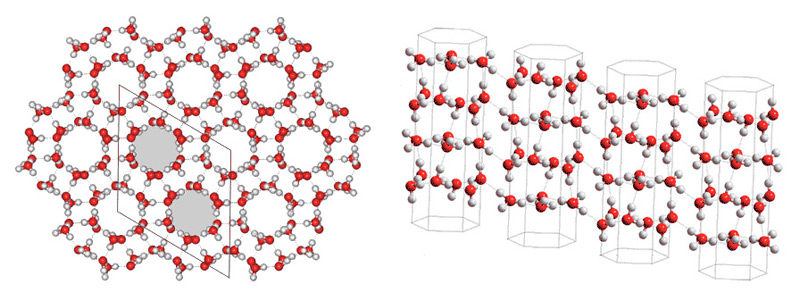
Гексагональные ледяные кристаллы образуют шестиугольные пластины и столбики; верхняя и нижняя грани в них являются базовыми плоскостями, а шесть одинаковых боковых граней называются призматическими (илл.10).
Минимальное количество молекул воды, необходимое для начала ее кристаллизации – около 275 (±25). В значительной степени образование льда происходит на поверхности водной массы, граничащей с воздухом, нежели внутри нее. Кристаллы крупнозернистого льда Ih медленно формируются в направлении оси с, например, в стоячей воде они растут вертикально вниз от кристаллических пластинок, или в условиях, где рост в сторону затруднен. Мелкозернистый лед, образующийся в неспокойной воде или при быстром ее замерзании, имеет ускоренный рост, направленный от призматических граней. Температура окружающей воды определяет степень разветвленности кристаллической решетки льда.
Частицы растворенных в воде веществ, за исключением атомов гелия и водорода, чьи размеры позволяют им поместиться в полостях структуры, при нормальном атмосферном давлении исключаются из кристаллической решетки, вытесняясь на поверхность кристалла или, как в случае с аморфной разновидностью (об этом дальше в статье) образуя слои между микрокристаллами. Последовательные циклы замораживания-оттаивания воды могут быть использованы для очистки ее от примесей, например, газов (дегазация).
Наряду со льдом Ih существует также лед Ic (кубическая сингония), правда, в природе образование этой разновидности льда изредка возможно только в верхних слоях атмосферы. Искусственно лед Ic получают путем моментального замораживания воды, для чего конденсируют пар на охлажденной от минус 80 до минус 110°С металлической поверхности при нормальном атмосферном давлении. В результате опыта на поверхность выпадают кристаллики кубической формы или в виде октаэдров. Создать кубический лед первой модификации из обычного гексагонального, понижая его температуру, не получится, а вот переход из кубического в гексагональный возможен при нагревании льда Ic выше минус 80°С.
В молекулярной структуре льда Ic угол водородных связей такой же, как и у обычного льда Ih – 109.5°. А вот шестигранное кольцо, образуемое молекулами, в решетке льда Ic присутствует только в форме шезлонга.
Плотность льда Ic равна 0.92 г/см³ при давлении в 1 атм. Элементарная ячейка в кубическом кристалле имеет 8 молекул и размеры: a=b=c = 6.35 Å, а ее углы α=β=γ = 90°.
На заметку. Уважаемые читатели, в данной статье мы неоднократно будем сталкиваться с показателями температуры и давления для того или иного типа льда. И если температурные значения, выраженные в градусах по Цельсию, всем понятны, то восприятие значений давления, возможно, для кого-то будет затруднено. В физике используются различные единицы для его измерения, но мы в нашей статье будем обозначать его в атмосферах (атм), округляя значения. Нормальное атмосферное давление составляет 1 атм, что равняется 760 мм ртутного столба, или чуть более 1 бара, или 0.1 МПа (мегапаскаль).
Как вы поняли, в частности, из примера со льдом Ic, существование кристаллических модификаций льда возможно в условиях термодинамического равновесия, т.е. при нарушении баланса температуры и давления, определяющего наличие какого-либо кристаллического вида льда, этот вид исчезает, переходя в иную модификацию. Диапазон этих термодинамических значений различается, для каждого вида он свой. Рассмотрим другие типы льда, не строго в номенклатурном порядке, а в связи с этими структурными переходами.
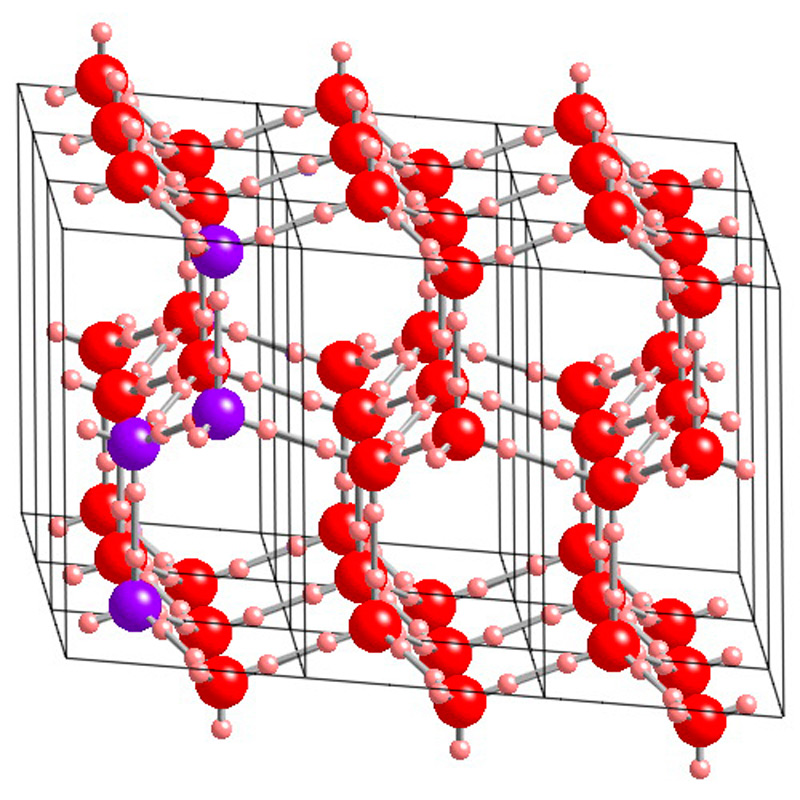
Лед II относится к тригональной сингонии. Он может образоваться из гексагонального типа при давлении около 3 000 атм и температуре около минус 75°С, или из другой модификации (лед V), путем резкого снижения давления при температуре минус 35°С. Существование II типа льда возможно в условиях минус 170°С и давлении от 1 до 50 000 атм (или 5 гигапаскалей (ГПа)). По оценкам ученых, лед такой модификации, вероятно, может входить в состав ледяных спутников дальних планет Солнечной системы. Нормальное атмосферное давление и температура выше минус 113°C создают условия для перехода этого типа льда в обычный гексагональный лед.
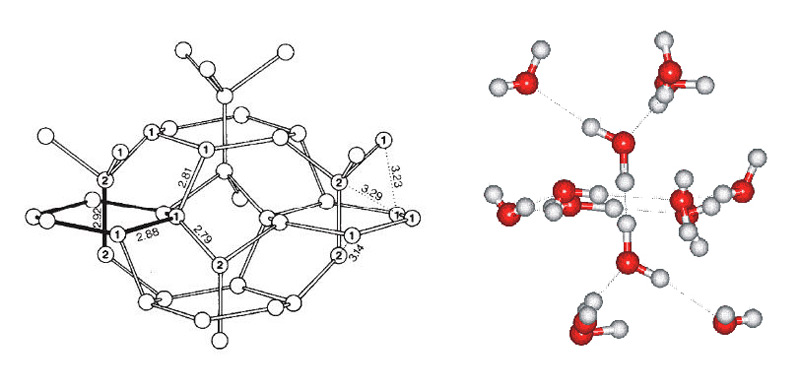
На иллюстрации 13 показана кристаллическая решетка льда II. Видна характерная особенность структуры – своего рода, полые шестиугольные каналы, образуемые молекулярными связками. Элементарная ячейка (область, выделенная на иллюстрации ромбом) состоит из двух связок, которые смещены относительно друг друга, условно говоря, «по высоте». В результате образуется ромбоэдрическая система решетки. Размеры ячейки a=b=c = 7.78 Å; α=β=γ = 113.1°. В ячейке 12 молекул. Угол связей между молекулами (О–О–О) варьируется от 80 до 120°.
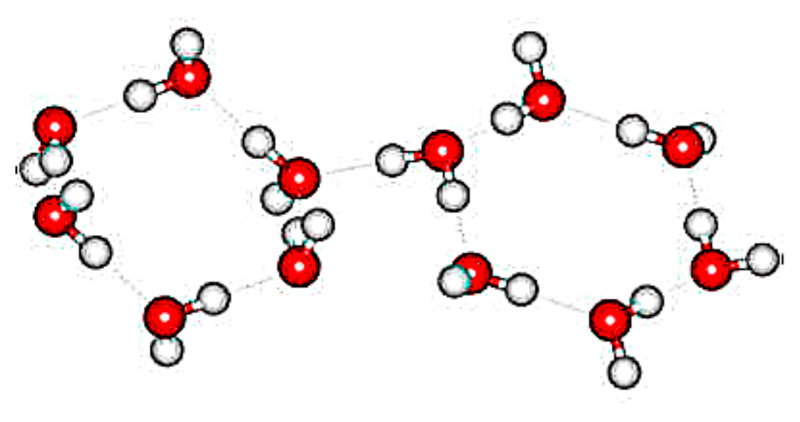
Илл. 14. Молекулярные связки (гексамеры) в решетке льда II, одна из которых изогнута в форме шезлонга, другая почти плоская.
При нагреве II модификации можно получить лед III, и наоборот, охлаждение льда III превращает его в лед II. Также лед III образуется, когда температуру воды постепенно понижают до минус 23°С, увеличивая давление до 3 000 атм.
Как видно на фазовой диаграмме (илл. 6), термодинамические условия для стабильного состояния льда III, а также другой модификации – льда V, невелики.
Льды III и V имеют четыре тройные точки с окружающими модификациями (термодинамические значения, при которых возможно существование разных состояний вещества). Тем не менее, льды II, III и V модификаций могут существовать в условиях нормального атмосферного давления и температуры минус 170°С, а нагревание их до минус 150°С приводит к образованию льда Ic.
По сравнению с другими модификациями высокого давления, известными в настоящее время, лед III облает наименьшей плотностью – при давлении 3 500 атм. она равна 1.16 г/см³.
Лед III является тетрагональной разновидностью кристаллизованной воды, но сама структура решетки льда III имеет нарушения. Если обычно каждую молекулу окружают 4 соседние, то в данном случае этот показатель будет иметь значение 3.2, и кроме того поблизости могут находиться ещё 2 или 3 молекулы, которые не имеют водородных связей.
В пространственном построении молекулы образуют правосторонние спирали.
Габариты элементарной ячейки с 12 молекулами при минус 23°С и около 2800 атм: a=b = 6,66, c = 6,93 Å; α=β=γ = 90°. Угол водородных связей в диапазоне от 87 до 141°.
На иллюстрации 15 условно представлена пространственная схема молекулярного строения льда III. Молекулы (точки голубого цвета), распложенные ближе к зрителю, показаны крупнее, а водородные связи (линии красного цвета) соответственно толще.
А теперь, как говорится, по горячим следам, давайте сразу «перескочим» идущие после льда III в номенклатурном порядке кристаллические модификации, и скажем несколько слов о льде IX.
Этот вид льда, по сути, измененный лед III, подвергнутый быстрому глубокому охлаждению от минус 65 до минус 108°С во избежание трансформирования его в лед II. Лед IX сохраняет устойчивость при температуре ниже 133°С и давлении от 2 000 до 4 000 атм. Его плотность и структура идентична III виду, но в отличие от льда III в структуре льда IX имеется порядок в расположении протонов.
Нагревание льда IX не возвращает его к исходной III модификации, а превращает в лед II. Размеры ячейки: a=b = 6,69, c = 6,71 Å при температуре минус 108°С и 2800 атм.
Кстати, роман писателя-фантаста Курта Воннегута (Kurt Vonnegut) 1963 г. «Колыбель для кошки» строится вокруг вещества, именуемого лед-девять, который описывается как искусственно полученный материал, представляющий большую опасность для жизни, так как вода при контакте с ним кристаллизуется, превращаясь в лед-девять. Попадание даже небольшого количества этого вещества в природную акваторию, выходящую к мировому океану, грозит замерзанием всей воды на планете, что в свою очередь означает гибель всего живого. В конце концов, так все и происходит.
Лед IV представляет собой метастабильное (слабоустойчивое) тригональное образование кристаллической решетки. Его существование возможно в фазовом пространстве льдов III, V и VI модификаций. Получить лед IV можно из аморфного льда высокой плотности, медленно нагревая его, начиная от минус 130°С при постоянном давлении 8 000 атм.
Размер элементарной ромбоэдрической ячейки составляет 7.60 Å, углы α=β=γ = 70.1°. Ячейка включает в себя 16 молекул; водородные связи между молекулами асимметричные. При давлении 1 атм и температуре минус 163°С плотность льда IV равна 1.27 г/см³. Угол связей О–О–О: 88–128°.
Аналогично IV типу льда образуется и лед XII – путем нагревания высокоплотной аморфной модификации (об этом ниже) от минус 196 до минус 90°С при том же давлении 8 000 атм, но уже с более высокой скоростью.
Лед XII также метастабилен в фазовой области V и VI кристаллических типов. Является разновидностью тетрагональной сингонии.
Элементарная ячейка содержит 12 молекул, которые, благодаря водородным связям с углами 84–135°, располагаются в кристаллической решетке, образуя двойную правостороннюю спираль. Ячейка имеет размеры: a=b = 8.27, c = 4.02 Å; углы α=β=γ = 90º. Плотность льда XII составляет 1.30 г/см³ при нормальном атмосферном давлении и температуре минус 146°С. Углы водородных связей: 67–132°.
Из открытых на сегодняшний день модификаций водяного льда самую сложную кристаллическую структуру имеет лед V. 28 молекул составляют его элементарную ячейку; водородные связи пролегают через зазоры в других молекулярных соединениях, а некоторые молекулы образуют связи только с определенными соединениями. Угол водородных связей между соседними молекулами сильно различается – от 86 до 132°, поэтому в кристаллической решетке льда V имеется сильное напряжение и огромный запас энергии.
Параметры ячейки при условиях нормального атмосферного давления и температуры минус 175°С: a= 9.22, b= 7.54, c= 10.35 Å; α=β = 90°, γ = 109,2 °.
Лед V – это моноклинная разновидность, образуемая охлаждением воды до минус 20°С при давлении около 5 000 атм. Плотность кристаллической решетки с учетом давления 3 500 атм составляет 1.24 г/см³.
Пространственная схема кристаллической решетки льда V типа показана на иллюстрации 18. Серым контуром выделена область элементарной ячейки кристалла.
Упорядоченное расположение протонов в структуре льда V делает его другой разновидностью, именуемой льдом XIII. Данную моноклинную модификацию можно получить в результате охлаждения воды ниже минус 143°С с добавлением соляной кислоты (HCl) для облегчения фазового перехода, создавая давление 5 000 атм. Обратимый переход от XIII типа к V типу возможен в диапазоне температур от минус 193°С до минус 153°С.
Размеры элементарной ячейки льда XIII слегка отличаются от V модификации: а= 9,24, b= 7,47, c= 10.30 Å; α=β = 90°, γ= 109,7 ° (при 1 атм, минус 193°С). Количество молекул в ячейке то же – 28. Угол водородных связей: 82–135°.
В следующей части нашей статьи мы продолжим обзор модификаций водяного льда.
До встречи на страницах нашего блога!