Здравствуйте, уважаемые читатели! Мы продолжаем нашу рубрику «Энциклопедия льда». За время существования блога Вольных Ледорубов, здесь набралось немало статей на ледяную тематику. Однако, как говорится, руки никак не доходили написать статью собственно про Лед, хотя логично и по праву стоило было начать наш блог именно с этой статьи, а уж обойти это стороной нам никак нельзя. Что ж, вот, мы наконец-то и добрались до самого предмета всех статей сайта ledovydom.ru и исправляем свою ошибку.
Лед – безусловно, уникальный материал. Несмотря на то, что он всем нам хорошо знаком, на самом деле он не такой простой, как кажется. Что собой представляет лед, как он образуется, какие бывают виды льда – обо всем этом мы расскажем вам в нашей Энциклопедии. Так как информации про лед имеется достаточно много, мы решили не включать все в одну статью, а разбить ее на отдельные заметки, сохранив порядок изложения, подобно параграфам в книге. Надеемся, что вам будет интересно.
Итак, дорогие читатели, знакомьтесь, Лед!
Если вас спросят, что такое лед, то вы без труда ответите, что это замерзшая вода, говоря иначе, вода, находящаяся в твердом агрегатном состоянии. Другое, в какой-то мере противоположное состояние воды – газообразное, или пар.
По своей природе вода является одним из самых удивительных веществ на нашей планете, просто хотя бы потому, что мы с вами без труда можем наблюдать ее во всех трех проявлениях, для образования которых не нужно каких-либо особых условий. К тому же, как вы знаете, чистая вода не имеет ни цвета, ни запаха, ни вкуса.
Примечателен и еще один факт. Он связан с пресловутой нулевой отметкой на температурной шкале Цельсия. Нередко люди задаются вопросом, что же происходит при нуле градусов: таяние льда или замерзание воды? Ответ: и то, и другое. Как же так получается? А фокус заключается в том, что в природе четкой температурной границы в нуль градусов не существует. Данное значение будет или со знаком «плюс», или со знаком «минус». Нуль своего рода нейтральная зона, где могут существовать и лед, и вода в жидком виде.
Кстати,… шведский ученый XVIII века Андерс Цельсий, предложивший свою систему измерения температуры, обозначил на шкале нулевую отметку, как точку кипения воды, а отметку в 100 градусов — как точку замерзания. Позже шкала была перевернута, по одной версии самим Цельсием, по другой – соотечественником Цельсия, натуралистом Карлом Линнеем, и в этом виде используется в настоящее время.
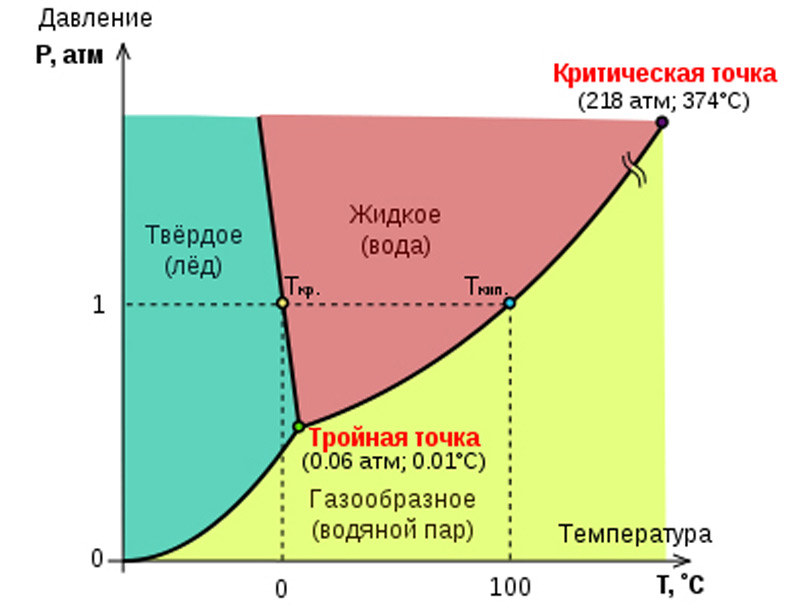
Другим важным фактором перехода воды из одного состояния в другое является атмосферное давление. Нормальное атмосферное давление, которое обозначается привычными для нас единицами измерения, составляет 760 мм ртутного столба или 1 атмосферу (атм). И здесь мы снова сталкиваемся с тем, что вода обладает необычными свойствами. Из школьного курса физики мы помним, что увеличение давления на вещество приводит к тому, что его атомы начинают сильнее прижиматься друг к другу, т.е. вещество становится плотнее. Этот процесс можно наглядно понять, если, к примеру, лепить снежный комок – чем сильнее вы сдавливаете снег, тем комок будет тверже. С водой же ситуация выглядит иначе. По мере возрастания давления на воду температура ее замерзания будет опускаться, равно, как и будет опускаться температура плавления льда, т.е. вода будет оставаться в жидком состоянии. В высокогорье, например, давление воздуха меньше из-за того, что воздух здесь разреженный (менее плотный), и, следовательно, вода превращается в лед при плюсовой температуре, а кипеть начинает уже при 80, а то и при 70°С.
Это интересно! Иллюстрация 3 представляет собой фазовую диаграмму воды – график агрегатных состояний в зависимости от температуры и давления. Как видно из диаграммы, при определенных термодинамических значениях: 0.01°С и 0.006 атм, и отсутствии других веществ, чистая вода может одновременно и равновесно существовать во всех трех фазах – лед, жидкость, пар. Изменение температуры или давления в ту или иную сторону приведет к потере одного из состояний.
Процессы замерзания воды и таяния льда зависят еще от уровня солености. Об этом мы уже писали в нашей статье Лед тает. Чем выше данный показатель, тем ниже температура замерзания. Так, например, морская вода представляет собой раствор солей, содержание которых в ней выше, чем в пресной, потому и замерзает морская вода при температуре ниже нуля. Степень солености измеряется в промилле (‰), и среднее значение для морской воды составляет 35‰ или 3.5 %, а температура ее замерзания около минус 2°C.
При формировании морского льда, соли выделяются из воды. Они отсутствуют в структуре ледяных кристаллов и образуют более соленые растворы, температура замерзания которых опускается еще ниже. Эти концентраты оказываются запертыми внутри ледяных массивов, но в случае, когда морская вода замерзает слишком медленно, соли будут постепенно вытесняться, а лед – становиться более пресным. Стоит также добавить, что от вкраплений таких растворов зависят физические свойства морского льда, о которых мы расскажем далее в нашей Энциклопедии льда. Об удивительном явлении, связанном с замерзанием морской воды, читайте в нашей статье Брайникл – морская сосулька.
Почему лед не тонет в воде?
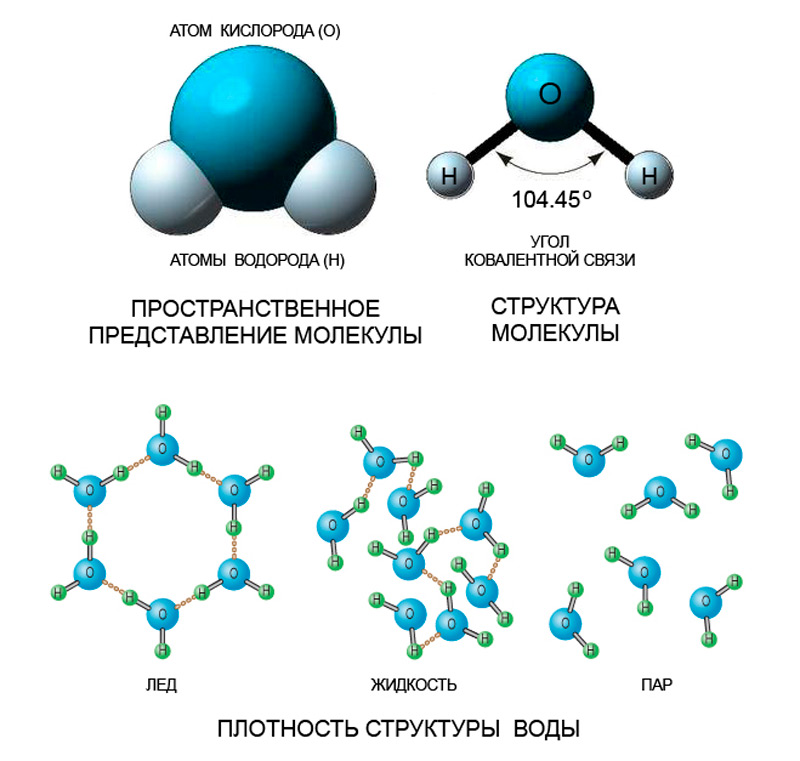
Теперь мы снова возвращаемся к феномену льда и воды. Следующее, обычное и в то же время необычное явление – это непотопляемость льда. Почему же лед не тонет в воде? Дело в разнице их плотности. На иллюстрации 4 представлены условные схемы положения молекул воды (H-O-H) относительно друг друга в различных состояниях: лед, жидкость, пар. Молекулы в газовой (паровой) фазе находятся в свободном движении – расстояние между ними большое (больше размеров самой молекулы), а силы притяжения не хватает, чтобы сблизить их.
В жидкой фазе связь между частицами плотная, но не одинаковая для всего вещества. Молекулы жидкой воды также не стоят на месте, но за счет сильного взаимного притяжения их движение ограничено. Что касается льда, то здесь частицы выстраиваются уже в упорядоченную структуру, на расстоянии, равном размеру одной молекулы. Нельзя сказать, что они становятся полностью статичными – молекулы продолжают свое движение, или, выражаясь научным языком, колеблются около положения равновесия. В случае с жидкостью помимо таких колебаний молекулы совершают резкие перемещения из одного состояния равновесия в другое; это и определяет текучесть воды.
Так как в твердой структуре воды молекулы располагаются друг от друга дальше, чем в жидкой, то, соответственно, сама структура льда становится более разреженной. В процессе замерзания ее объем увеличивается на 9%, это в свою очередь говорит о том, что плотность льда ниже плотности жидкой воды. При температуре 0°C плотность льда и воды составляет соответственно 0,916 г/см³ и 0,998 г/см³. Вот поэтому лед и легче воды.
Хотите – верьте, хотите – проверьте. Удостовериться, что вода расширяется в объеме при замерзании, можно на опыте в домашних условиях. Дождитесь морозных дней. Возьмите бутылку, в целях безопасности пластиковую, наполните доверху водой, закройте крышку и поставьте на балкон. Вода замерзнет, а бутылка лопнет.
Как правило, плотность веществ увеличивается при их охлаждении и уменьшается при их нагревании. Чтобы легче запомнить это и не путаться, представьте, что вы стоите на улице в холодную погоду и мерзнете – волей-неволей вы начинаете съеживаться, прижимать руки к телу, укутываться плотнее, т.е. как бы сжиматься. В жару, наоборот, вам хочется раскрыться, снять одежду, расставить руки, чтобы увеличить площадь тела для охлаждения. Вот и веществам приходится также нелегко.
Вода (в том числе и лед), как вы поняли, ведет себя не так, вернее сказать, не совсем так. Охлаждаясь до определенного момента, вода сжимается, как и все «обычные» вещества. Этим определенным моментом является отметка в 4°С, с учетом нормального атмосферного давления, разумеется. При этой температуре вода обладает наибольшей плотностью — 1 г/см³ (проще говоря, 1 литр воды весит 1 кг). На нулевой отметке происходит описанная нами аномалия с изменением плотности. Ну, а после того, как вода превратилась в лед, этот процесс снова нормализуется – последующее охлаждение льда увеличивает показатель его плотности.
В связи с этим разберемся, как образуется лед на примере природных водоемов и водотоков. В холодное время года в водах рек и озер происходит конвективное движение – находящаяся ближе к поверхности вода остывает сильнее, становится плотнее и оседает на глубину, выталкивая при этом более теплую воду. Постепенно вся вода, перемешиваясь, приобретает одинаковую температуру 4°С. Дальнейшее понижение температуры воды приводит к тому, что холодная вода уже не опускается, а наоборот поднимается к поверхности, т.к. плотность воды ниже 4°С становится меньше.
Дальнейшее развитие событий становится уже понятным. Поверхностный слой воды, охлажденной до 0°C, превращается лед, который постепенно начинает расти в глубину. Скорость образования и толщина ледяного слоя зависит от разных факторов: температуры воздуха, силы ветра, течения воды, толщины снегового покрова, а также человеческого воздействия. В небольшой фотозаметке Ледяные явления. Часть вторая вы можете посмотреть, как причудливо может формироваться лед на озерах и реках.
Удивительно то, что разница в плотности воды у поверхности и на глубине совсем небольшая, но этого хватает, чтобы ледяная вода не опустилась глубже. Этот природный механизм терморегулирования поистине уникален, т.к. благодаря ему жизнь под водой продолжается и в суровых условиях. Если бы вода не обладала такими свойствами, то реки и озера промерзали бы до дна, а так ледяной щит, являясь плохим проводником тепла (а значит, хорошим теплоизолятором) защищает от холода подводную фауну и флору. Лед нарастает до такой толщины, которая позволяет воде не охлаждаться дальше и не замерзать.
Как образуется лед.
Давайте рассмотрим процесс формирования льда еще ближе. Для того чтобы началась кристаллизация воды, одной только низкой температуры недостаточно. Когда вода достигает нужного температурного значения, некоторые молекулы начинают объединяться друг с другом в кристаллические группы, но состояние таких объединений нестабильно – они разрушаются вследствие теплового движения частиц внутри вещества. Прежде, чем выстраиваться в упорядоченную кристаллическую решетку, молекулам воды необходимо к чему-нибудь закрепиться и собраться в большом количестве. Такими основами для кристаллизации служат различные примеси, находящиеся в воде, пузырьки воздуха или уже имеющиеся кристаллики льда (вы также можете прочесть об этом в нашей статье Снежинки – ледяные скульптуры). Если в воде отсутствуют центры кристаллизации, она может переохладиться и оставаться в жидком состоянии при очень низкой температуре.
Кстати,… Слово «кристалл» происходит от древнегреческого κρύσταλλος и означает «лед»
А теперь придется ненадолго погрузиться в химию и разобраться в структуре воды и льда на молекулярном уровне.
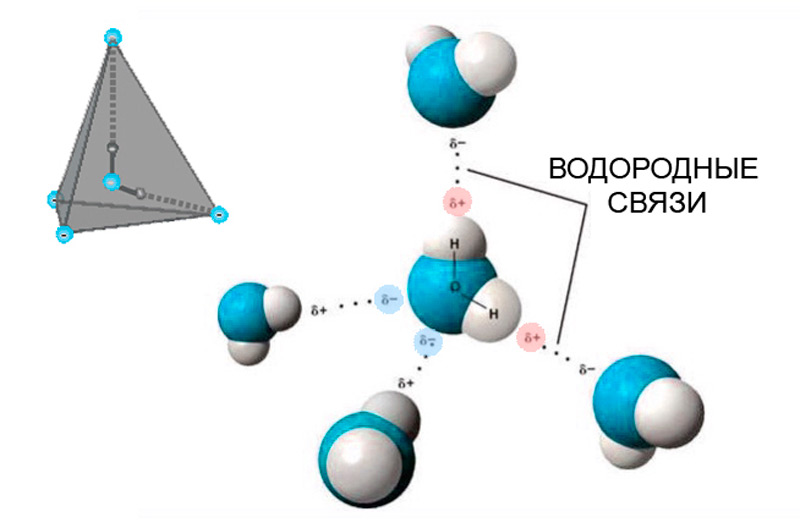
Необычные свойства, которыми обладает вода во всех трех проявлениях, объясняется ее молекулярным строением. Чуть выше, на иллюстрации 4 показано схематическое изображение молекулы воды (H2O). Как видно, атомы водорода располагаются с двух сторон от атома кислорода, образуя с ним ковалентную связь. У свободной молекулы (вода в состоянии пара) угол между осями ковалентных связей составляет 104.45° из-за того, что атомы водорода, имея одинаковый положительный заряд, отталкивают друг друга. С изменением агрегатного состояния этот угол меняется. В условиях жидкости он будет шире – 106°, а для льда значение еще больше – 109.5°.
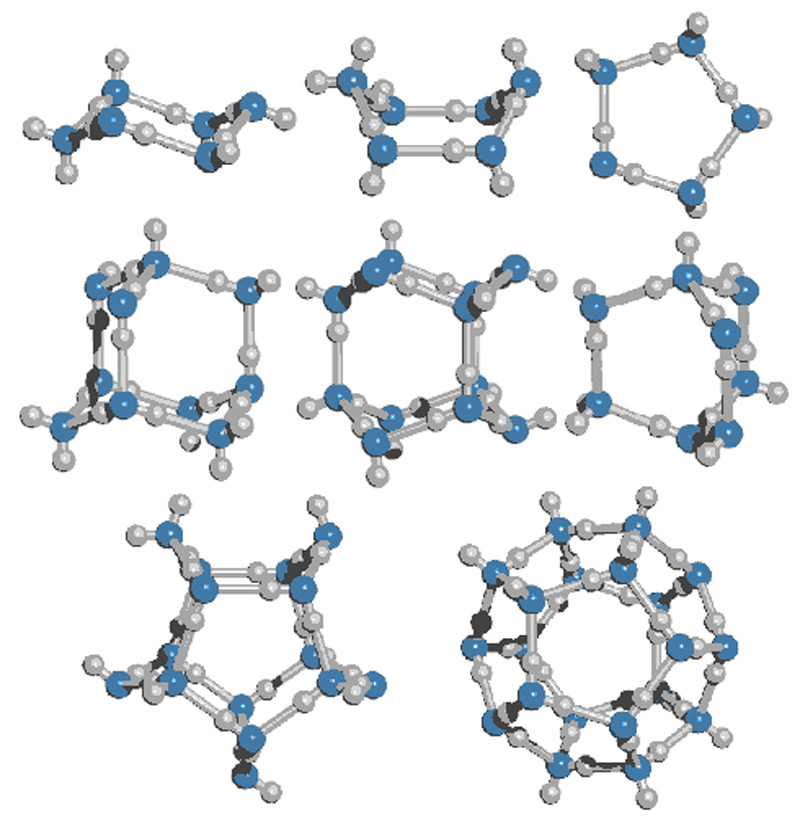
Устройство самой молекулы определяет и всю структуру воды в твердом и жидком состоянии (илл. 6). Атом кислорода, являясь своеобразным центром молекулы воды, кроме ковалентной связи с двумя атомами водорода, имеет еще две неподеленные пары электронов для связей с атомами водорода других молекул; эти две пары также испытывают взаимное отталкивание. Все они расположены в молекуле таким образом, что направления их электрических зарядов образуют трехмерную основу в форме четырехгранника (тетраэдра). Получается, что каждая молекула воды может окружить себя четырьмя другими молекулами. Эти связи между ними называются водородными. В свою очередь, такой тетраэдр является базовым сегментом для строительства всей кристаллической решетки (илл. 7, 8). Привычный для нас лед имеет структуру, состоящую из шестиугольных ячеек, поэтому его называют гексагональным (подробнее об этом мы расскажем в нашей следующей статье).
При нагревании льда до температуры плавления менее прочные, чем ковалентные, водородные связи ослабевают, и твердое тело переходит в жидкое состояние. Однако кристаллическая решетка не разрушается полностью – талая вода содержит в себе так называемые кластеры, кратковременные молекулярные соединения различной формы, переходящие друг в друга (илл. 9). В то же время отдельные молекулы заполняют пространство, которое пустовало в кристаллической решетке льда, отсюда и увеличение плотности воды в пределах 4°C, о чем мы уже говорили.
Дальнейшее нагревание жидкой воды приводит к разреженной структуризации, при этом продолжается группирование (ассоциация) и разгруппирование (диссоциация) частиц, вкупе с движением отдельных молекул.
Вот такой интересный механизм представляет собой переход воды из жидкости в лед, и обратно!
Что ж, друзья, мы с вами немного разобрались в основных свойствах льда, тех, что привыкли видеть невооруженным глазом. В наших последующих статьях мы разберем остальные характеристики льда, явления, происходящие со льдом и водой, а также постараемся приоткрыть завесу других тайн из мира льда.
Будем рады видеть вас на нашем сайте! До новых встреч!

Автор статьи Ренат «Дед» Сафин.